波多野Gの研究成果2011〜
▼キラルリチウムビナフチルジスルホン酸塩触媒を⽤いるアルジミンのエナンチオ選択的Strecker型反応
Manabu Hatano, Kosuke Nishio, Takuya Mochizuki, Keisuke Nishikawa, Kazuaki Ishihara*
ACS Catal. 2019, 9(xxx), 8178-8186.
Publication Date:July 30, 2019
DOI: 10.1021/acscatal.9b02739
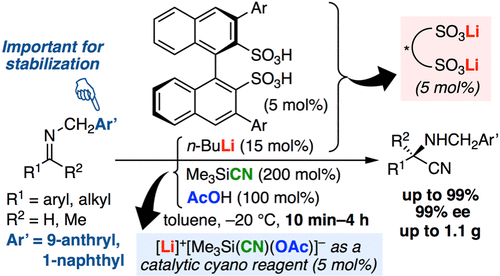
我々は、ケトン及びα,β-不飽和カルボニル化合物の不斉シアノ化反応に有効なキラルリチウムホスホリルフェノキシド触媒を開発済みである。本反応システムは系中でキラルリチウムアクア錯体を形成させるとともに、LiCNとMe3SiCNから高活性5配位シリカートを調製することで高い反応活性を実現している。しかし、より不活性なアルジミンのシアノ化は困難であった。そこで今回は、高い酸性度が期待できる(R)-3,3’-Ar2-BINSAを不斉配位子とするキラルリチウム塩触媒を創製した。適量の酢酸存在下で本配位子とn-BuLiから系中で触媒を調製し、トリメチルシリルシアニドによるアルジミンのエナンチオ選択的Strecker型反応を行なった。その結果、幅広い芳香族及び脂肪族アルジミンの基質に適用できた。グラムスケールの反応にも成功した。さらに、得られた生成物は高い光学純度を維持したまま光学活性α-アミノ酸誘導体へ変換できた。

▼トリス(ペンタフルオロフェニル)ボランで活性化されたキラルリン酸触媒を用いる逆電子要請型ヘテロDiels–Alder反応の開発
Manabu Hatano, Tatsuhiro Sakamoto, Takuya Mochizuki, Kazuaki Ishihara*
Asian J. Org. Chem. 2019, 8(7), 1061-1066.
Version of Record online:01 April 2019
DOI:
10.1002/ajoc.201900104

我々はアキラルなLewis酸とキラルBINOLリン酸から系中で調製するキラル超分子触媒を開発済みである。今回、本触媒を用いてアクロレインとビニルスルフィドを基質とするエナンチオかつジアステレオ選択的[4+2]付加環化反応(逆電子要請型ヘテロDiels–Alder反応)を開発した。エチルビニルスルフィドとα-アリール置換したアクロレイン基質に対して、触媒と反応条件を精密調整することで、反応選択性([2+2] vs. [4+2])をはじめとするマルチ制御に成功した。得られた化合物は、脱硫反応を経て光学活性な有用化合物へ誘導した。

▼キラルU字型超分子触媒を用いるプロパルギルアルデヒドによるマルチ選択的Diels-Alder反応
Publication Date (Web): November 7, 2018

我々は系中で調製するテーラーメイド型キラル超分子Lewis酸触媒を開発している。今回、本触媒を用いてプロパルギルアルデヒドと種々の環状ジエンおよびトリエンを基質とするエナンチオ、エンド/エキソ、レジオ、π面、サイト、基質選択的Diels-Alder反応を開発した。酵素のように柔軟で狭い鍵穴の制御により過剰反応を抑えつつ、本触媒でしか合成できない特異な生成物を高収率かつマルチ選択的に得ることに成功した。

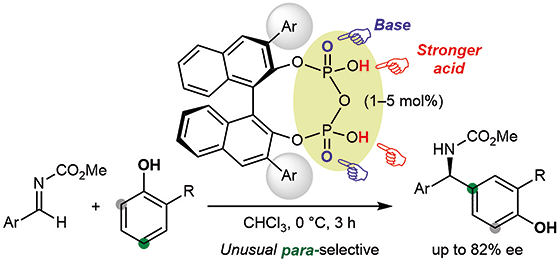
▼キラルピロリン酸触媒を用いるフェノールのパラ及びエナンチオ選択的アザ-Friedel-Crafts反応
The article was first published on 22 August 2018
Synthesis 2018, 50(23), 4577-4590.
フェノールのアルジミンに対するパラ及びエナンチオ選択的アザ-Friedel-Crafts反応に有効なキラルBINOLに由来するピロリン酸触媒を創製した。オルト・パラ配向性を持つフェノールは、本触媒存在下、遠隔位の相当する不利なパラ位で選択的に反応し、中〜高エナンチオ選択性で対応する生成物を与えた。グラムスケールアップも可能であり、抗菌薬(水虫薬)である(R)-ビホナゾールの鍵中間体の簡略合成に成功した。

▼キラルビスリン酸触媒を用いるα-ケチミノエステルと2-メトキシフランのエナンチオ選択的アザ-Friedel-Crafts反応
The article was first published on 25 Jun 2018
Chem. Sci. 2018, 9(30), 6361-6367.
DOI: 10.1039/C8SC02290A
キラルリン酸触媒が持つ酸・塩基複合機能に着目し、その多様性を拡張するためにキラルビナフトール由来のC2対称キラルビスリン酸触媒を開発した。C2対称触媒は、2つのP(=O)OH部位の分子内水素結合ネットワークによる環形成に伴って、嵩高い3,3’位のアリール基の近傍に位置する環外のP-OHの酸性度が向上するため、触媒活性の大幅な向上と高い立体制御効果が期待できる。今回、C2対称触媒を用いてβ,γ-アルキニル-α-イミノエステル3と2-メトキシフラン4のアザ-Friedel–Crafts反応を検討した。その結果、高度に官能基化した第四級不斉炭素を有するα-アミノ酸誘導体生成物を高エナンチオ選択的に得た。一方、キラルビナフトール骨格の片側の3位に嵩高いアリール基を有するC1対称キラルビスリン酸触媒も開発した。C1対称触媒は、アルキンに代わってアリール基を有するα-ケチミノエステル5と4のアザ-Friedel–Crafts反応に有効だった。それぞれの反応で得られた高い光学純度を有する生成物は、2’-インドールと2’-ナフトキノールを含有する複雑な光学活性α-アミノ酸誘導体や光学活性α-アリール置換セリンへと誘導した。

Selected as a Back Cover Picture
Chem. Sci. 2018, 9(30), 6453-6454.
DOI: 10.1039/C8SC90158A
▼三臭化ホウ素で活性化されたキラルリン酸触媒を用いるエナンチオ選択的[2+2]環化付加反応
First published: 30 March 2018
https://doi.org/10.1002/asia.201800351
DOI: 10.1002/asia.201800351

キラルリン酸触媒に三臭化ホウ素(BBr3)を加えることにより系中で調製する高活性ルイス酸複合型キラルリン酸触媒を用いて、フェニルビニルスルフィドとアクロレインとの不斉触媒的[2+2]付加環化反応を達成した。キラルBrønsted酸としては初めての不斉触媒的[2+2]付加環化反応の例であり、特筆される。本反応で得られる生成物は光学活性シクロブタンであることから、合成上有用である。特に、メタクロレインとの反応から得られた生成物は、数段回の化学変換を経て、アジアゾウの性ホルモンである(+)-frontalinの鍵中間体の初めての高効率合成に成功した。
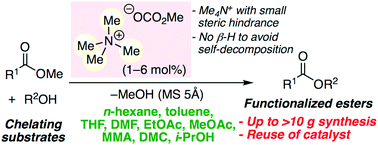
▼高活性アンモニウム塩触媒を用いる環境調和型エステル合成
Metal-Free Transesterification Catalyzed by Tetramethylammonium Methyl Carbonate
Manabu Hatano, Yuji Tabata, Yurika Yoshida, Kohei Toh, Kenji Yamashita, Yoshihiro Ogura, and Kazuaki Ishihara*
Green Chem. 2018, 20(6), 1193–1198.
エステル交換反応には金属塩触媒が多く用いられてきた。しかし、毒性や着色の問題、配位性の高い基質を用いると触媒活性が大幅に低下するという本質的な問題がある。今回、我々は従来の金属塩触媒1の問題を解決する高活性第四級アンモニウム塩触媒[Me4N]+[OCO2Me]–を開発した。幅広い基質や溶媒に対応できるうえ、グラムスケールアップや触媒回収再利用も可能である。バイオディーゼル合成に向けたモデル反応として脂肪酸グリセリドから脂肪酸メチルエステルの100グラム合成も達成した。実用性の高い環境調和型のエステル合成法として、工業的プロセスへ導入が期待される。
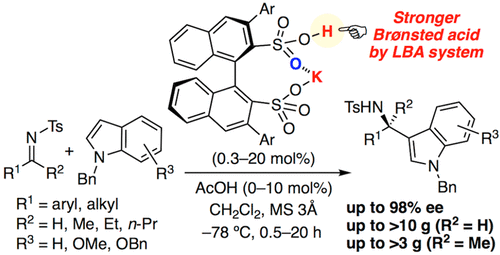
▼キラルカリウムビナフチルジスルホン酸塩触媒を用いるケチミンとインドールのエナンチオ選択的アザ-Friedel-Crafts反応
Enantioselective Aza-Friedel-Crafts Reaction of Indoles with Ketimines Catalyzed by Chiral Potassium Binaphthyldisulfonates
Manabu Hatano, Takuya Mochizuki, Keisuke Nishikawa, Kazuaki Ishihara*
キラルBrønsted酸触媒の設計では、基質や反応剤に応じた酸性度の調節は重要である。特に、我々は強酸性のキラルビナフチルジスルホン酸(BINSA)に着目してきた。今回、キラルカリウムビナフチルジスルホン酸塩触媒を創製し、不活性な単純ケチミンとインドールの初めての不斉アザ-Friedel-Crafts反応を開発した。触媒量の酢酸の添加は反応を促進し、触媒量の低減とグラム合成に成功した。

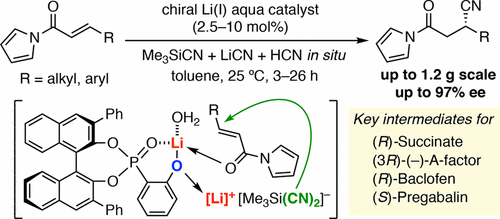
▼キラルリチウム(I)ホスホリルフェノキシド触媒を用いるα,β-不飽和N-アシルピロールのエナンチオ選択的共役シアノ化反応
Enantioselective Conjugate Hydrocyanation of α,β-Unsaturated N-Acylpyrroles Catalyzed by Chiral Lithium(I) Phosphoryl Phenoxide
Manabu Hatano, Katsuya Yamakawa, Kazuaki Ishihara*
当研究室では、既にケトンのエナンチオ選択的シアノシリル化反応に有効なLewis酸¬–Lewis塩基複合型キラルリチウム(I)ホスホリルフェノキシド触媒を開発済みである。今回、本触媒を用いるα,β-不飽和-N-アシルピロールのエナンチオ選択的共役シアノ化反応を開発した。トリメチルシリルシアニド由来の高活性5配位シリカートを系中で調製するとともに、水によるシアン化水素とモノメリックなリチウムアクア錯体の生成によって本触媒は高い触媒活性を示した。β位に様々な芳香族および脂肪族置換基を有する基質に適用できる上、グラムスケールの反応にも成功した。さらに、簡便な化学変換で生成物を有機合成上有用な光学活性化合物に導いた。
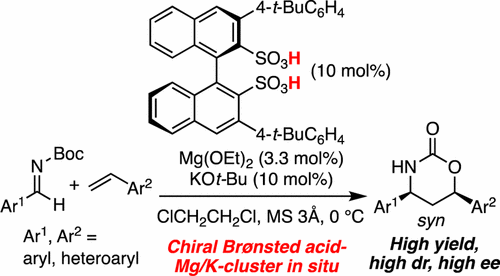
▼キラルビナフチルジスルホナートクラスター触媒を用いるスチレン類とアルジミンのエナンチオ選択的付加環化反応
Enantioselective Cycloaddition of Styrenes with Aldimines Catalyzed by a Chiral Magnesium Potassium Binaphthyldisulfonate Cluster as a Chiral Brønsted Acid Catalyst
Manabu Hatano, Keisuke Nishikawa, and Kazuaki Ishihara*
J. Am. Chem. Soc. 2017, 139(24), 8424-8427.
Publication Date (Web): May 30, 2017 (Communication)
DOI: 10.1021/jacs.7b04795
強い酸性を有するキラルビナフチルジスルホン酸(BINSA)は、キラル有機触媒及びキラル配位子として高い触媒活性の誘起が期待できる。今回、新規キラルカリウムマグネシウムビナフチルジスルホナートクラスター触媒を開発し、スチレンとアルジミンの初めての高エナンチオ選択的付加環化反応を開発した。得られた生成物は、光学活性γ-アミノアルコールなどの有用化合物や生物活性物質に変換できた。

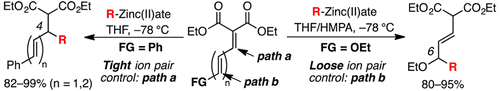
▼Grignard反応剤由来の高活性亜鉛アート錯体を用いる多重共役エステルへの高位置選択的アルキル付加反応
Regioselective 1,4- and 1,6-Conjugate Additions of Grignard Reagent-Derived Organozinc(II)ates to Polyconjugated Esters
Manabu Hatano, Mai Mizuno, and Kazuaki Ishihara*
Org. Lett. 2016, 18(18), 4462-4465.
Publication Date (Web): September 7, 2016 (Letter)
DOI:
10.1021/acs.orglett.6b01774
一般に、Grignard反応剤による不飽和カルボニル化合物に対するアルキル付加反応の位置選択性の制御は難しい。今回、我々はGrignard反応剤と塩化亜鉛から速やかに調製される高活性亜鉛アート錯体を用いて高位置選択的アルキル付加反応の開発を行った。亜鉛アート錯体の特性に合致したマロン酸由来の多重共役エステルの分子設計を行うことで、β位及びω位への高位置選択的アルキル付加反応を実現した。

▼“CN…B”及び“PO…B”配位結合を活かしたキラル超分子Lewis酸触媒によるエナンチオ選択的Diels–Alder反応
Enantioselective Diels–Alder Reaction Induced by Chiral Supramolecular Lewis Acid Catalysts Based on CN···B and PO···B Coordination Bonds
Manabu Hatano, Kazushi Hayashi, Tatsuhiro Sakamoto, Yuma Makino, Kazuaki Ishihara*
Synlett 2016, 27(17), 1061-1067. (Web Publication Date: 05 February 2016)
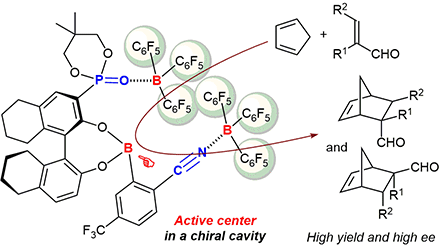
我々は、ホスホリル基やアミド基とトリス(ペンタフルオロフェニル)ボランとの配位結合を鍵とするキラル超分子Lewis酸触媒を開発済みである。今回、3位に置換基を有するキラルビナフトールと2-シアノフェニルボロン酸を分子設計し、シアノ基とトリス(ペンタフルオロフェニル)ボランとの配位結合を活かしたキラル超分子Lewis酸触媒を創製した。本触媒の機能をDiels–Alder反応で評価した結果、ビナフチル骨格とビナフトールの3位の置換基はエナンチオ選択性に影響し、ボロン酸の5位の置換基はエナンチオ選択性と収率の両方に影響することがわかった。錯体やモデル中間体の配位結合の根拠を示す結果をもとに、触媒構造についても議論した。

▼高配位シリカートを鍵とするキラルリチウム(I)ホスホリルフェノキシド触媒を用いるケトンのエナンチオ選択的シアノシリル化反応
Enantioselective Cyanosilylation of Ketones with Lithium(I) Dicyanotrimethylsilicate(IV) Catalyzed by a Chiral Lithium(I) Phosphoryl Phenoxide
Manabu Hatano, Katsuya Yamakawa, Tomoaki Kawai, Takahiro Horibe, Kazuaki Ishihara*
Angew. Chem. Int. Ed. 2016, 55(12), 4021-4025.
Article first published online: 2 FEB 2016.

ケトンのエナンチオ選択的シアノシリル化反応に有効なLewis酸–Lewis塩基複合型キラルリチウム(I)ホスホリルフェノキシド触媒を開発した。トリメチルシリルシアニドに加えてシアン化水素と触媒量の5配位シリカートと水の共存によって触媒活性が大幅に向上した。本触媒は様々な芳香族および脂肪族ケトンに適用できることに加え、30グラムスケールの反応にも成功した。従来の触媒では適用困難なケトンに由来する生成物の一つを誘導し、短工程でスペルミジンアルカロイドの鍵合成中間体を光学的に純粋に得た。基質一般性と併せて、錯体や反応剤などのESI-MSによる分析結果に基づいて、反応機構についても考察した。

▼遠隔位のホウ素Lewis酸で活性化されたキラルリン酸触媒を用いるエナンチオ選択的Diels–Alder反応
Remote Tris(pentafluorophenyl)borane-Assisted Chiral Phosphoric Acid Catalysts for the Enantioselective Diels–Alder Reaction
Manabu Hatano, Hideyuki Ishihara, Yuta Goto, Kazuaki Ishihara*
Synlett 2016, 27(4), 564-570.
DOI: 10.1055/s-0035-1560369
https://www.thieme-connect.de/products/ejournals/abstract/10.1055/s-0035-1560369
α-置換アクロレインとシクロペンタジエンのDiels-Alder
反応に有効なトリス(ペンタフルオロフェニル)ボランで活性化されたキラル超分子リン酸触媒を開発した。遠隔位に配位した二つのボランで触媒活性中心の酸性度を向上させるとともに深いキラルキャビティーを構築した。さらに本触媒はカテコールボランを加えることでブレンステッド酸複合触媒のみならずルイス酸複合触媒としても機能した。

▼三臭化ホウ素で活性化されたキラルリン酸触媒を用いる1,2-ジヒドロピリジンのエナンチオ選択的Diels-Alder反応
Boron Tribromide-Assisted Chiral Phosphoric Acid Catalyst for a Highly Enantioselective Diels-Alder Reaction of 1,2-Dihydropyridines
Manabu Hatano, Yuta Goto, Atsuto Izumiseki, Matsujiro Akakura, and Kazuaki Ishihara*
J. Am. Chem. Soc. 2015, 137(42), 13472-13475.
DOI: 10.1021/jacs.5b08693
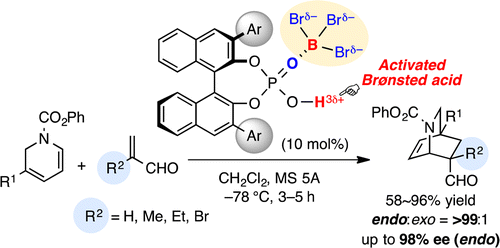
一般に、キラルリン酸触媒の酸性度ではカルボニル化合物の活性化は困難である。そこで我々はキラルリン酸触媒に三臭化ホウ素を加えることにより系中で調製する高活性ルイス酸複合型キラルリン酸触媒を開発した。本触媒を用いて、α-置換アクロレインと1,2-ジヒドロピリジン誘導体を基質に用いるエナンチオ選択的Diels–Alder反応を検討した結果、対応する光学活性イソキヌクリジンを高収率かつ高エナンチオ選択的に得た。さらに、これらの生成物に対して様々な化学変換を検討し、インドールアルカロイドの鍵中間体に誘導した。

▼グリニャール反応剤由来の亜鉛アート錯体を用いるアルルジミノエステルへのC-及びN-選択的アルキル付加反応
C- and N-Selective Grignard Addition Reactions of α-Aldimino Esters in the Presence or Absence of Zinc(II)
Chloride: Synthetic Applications to Optically Active Azacycles
Manabu Hatano, Kenji Yamashita, Kazuaki Ishihara*
Org. Lett. 2015, 17(10), 2412-2415.
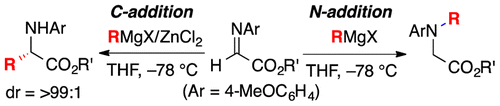
塩化亜鉛の有無によるGrignard付加反応を使い分けることで、アルジミノエステルへの実用的なC-及びN-選択的アルキル付加反応を開発した。塩化亜鉛を用いた場合には求核剤の極性が増大した亜鉛アート錯体の生成が鍵になっている。特に光学活性なアルジミノエステルを塩化亜鉛の存在下で用いると、ジアステレオ選択的なC-選択的アルキル付加反応が起こり、高収率で光学活性アミノ酸等価体を得た。さらに得られたC-アルキル付加体は合成的に有用な様々な含窒素ヘテロ環化合物(ピペリジン、アゼパン、インドール、インドリンなど)へと誘導できた。塩化亜鉛の有無という簡便な操作で反応位置の制御を行える本法は、有機合成上実用性が高い優れた合成手法であり、工業的な利用が大いに期待できる。

▼グリニャール反応剤由来の亜鉛アート錯体を用いるβ,γ-アルキニル-α-イミノエステルへの位置及び立体選択的アルキル付加反応
■C-Selective and Diastereoselective Alkyl Addition to β,γ-Alkynyl-α-imino Esters with Zinc(II)ate
Complexes
Manabu Hatano, Kenji Yamashita, Mai Mizuno, Orie Ito, Kazuaki Ishihara*
Angew. Chem. Int. Ed. 2015, 54, 2707-2711.
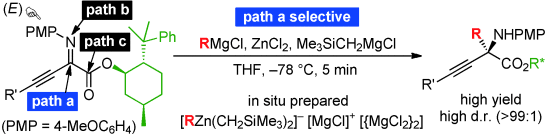

極性転換が生じているα-イミノエステルは、イミノ窒素、イミノ炭素、エステル炭素に連続する3つの反応点が存在し、多様な分子変換が可能である。しかし位置選択的な付加反応の制御は困難で、通常は複数の経路(a〜c)に由来する混合物になる。特に、安価で汎用性が高いGrignard反応剤を用いて経路aでイミノ炭素選択的なアルキル付加を行えれば、様々なα-アミノ酸誘導体の簡便かつ効率的な合成法となるが、従来の合成技術では達成されていなかった。これに対して当研究グループでは、塩化亜鉛とGrignard反応剤由来の高活性亜鉛アート錯体を用いる高イミノ炭素選択的アルキル付加反応を開発した。不斉補助基の8-フェニルメンチル基を導入した光学活性α-イミノエステルを用いると、経路aに基づくイミノ炭素選択的アルキル付加反応が5分以内に完結した。その結果、完璧なジアステレオ選択性(dr=>99:1)で対応する光学活性α-アミノ酸誘導体を高収率で得た。求電子的アルキル化剤では導入できない第2級アルキル基やアリール基をα位に求核的に導入できる本法は、従来にない新規な人工アミノ酸ライブラリーを構築できる。
▼キラル超分子マグネシウム(II)ビナフトラート触媒を用いる直截的不斉Mannich型反応と不斉ヘテロDiels-Alder反応
■Chiral Supramolecular Magnesium(II) Binaphtholate Catalysts for the Enantioselective Direct Mannich-Type Reaction and Hetero-Diels–Alder Reaction
Manabu Hatano, Takahiro Horibe, Kenji Yamashita, Kazuaki Ishihara*
Asian J. Org. Chem. 2013, 2, 952-956.
(Special Issue: 40 Years of the Mukaiyama Aldol Reaction, 1973–2013)
▷DOI: 10.1002/ajoc.201300190

我々は、適切なモル比のMg(II)イオン、光学活性ビナフトール、水から自己組織化して生じるキラル超分子Mg(II)ビナフトラート触媒がα,β-不飽和カルボニル化合物への不斉リン求核付加反応に有効であることを見出している。今回、本キラル超分子Mg(II)触媒を用いて既知の直截的不斉Mannich型反応及び不斉ヘテロDiels-Alder反応を検討した結果、反応性やエナンチオ選択性が大きく向上した。

▼光学活性3,3’-ジアリールビナフチルスルホン酸の合成
■Synthesis of Optically Pure 3,3′-Diaryl Binaphthyl Disulfonic Acids via Stepwise N–S Bond Cleavage
Manabu Hatano, Takuya Ozaki, Keisuke Nishikawa, Kazuaki Ishihara
J. Org. Chem. 2013, 78, 10405-10413.
DOI: 10.1021/jo401848z
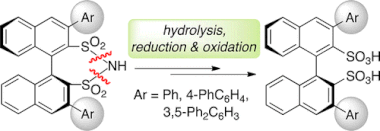
■一般にキラルビナフチル化合物の3,3’位へのアリール基やシリル基などの置換基導入は、立体的及び電子的効果から触媒設計の常套手段である。キラルビナフチルスルホン酸(BINSA)においても、新たな不斉触媒反応を開拓するにあたって3,3’位への置換基導入が期待されるが、合成の困難さからほとんど報告がなかった。合成の鍵は、鈴木–宮浦カップリング反応、Newman–Kwart転位、酸化の各段階を適切な順番でいかに効率良く実現できるかにある。我々は、キラル3,3’-ジアリールビナフチルジスルホンイミドを出発原料とするスルホンイミドのジスルホン酸への変換によるキラル3,3’-ジアリールBINSAの合成に着目した。一見すると単純な合成ルートであるが、脱保護の困難さは容易に想像できる。検討の結果、Red-Alによる選択的還元と酸素による収束的酸化を組み合わせることで、目的のキラルキラル3,3’-ジアリールBINSAの高収率合成に成功した。

▼キラル超分子マグネシウム(II)ビナフトラート触媒を用いる有機リン求核剤の α,β-不飽和エステル及びケトンへの高エナンチオ選択的付加反応
■Chiral Magnesium(II) Binaphtholates as Cooperative Brønsted/Lewis Acid–Base Catalysts for the Highly Enantioselective Addition of Phosphorus Nucleophiles to α,β-Unsaturated Esters and
Ketones
Manabu Hatano, Takahiro Horibe, Kazuaki Ishihara
Angew. Chem. Int. Ed. 2013, 52(17), 4549-4553.
DOI: 10.1039/C2CC34987F
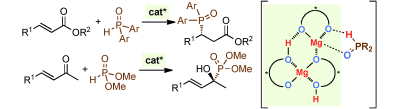
■α,β-不飽和カルボニル化合物に対する有機リン求核剤の1,2-及び1,4-位置選択的かつエナンチオ選択的付加反応は、光学活性有機リン化合物の重要な合成法である。しかし、一般的なケトンやエステルは反応性が低いため、生成物の有用性にもかかわらず、これらに適用できる活性の高い触媒は開発されていなかった。当研究グループは、ミネラルとして体内の必須元素でもある毒性の低いマグネシウムイオン(Mg2+)と入手容易で安価な光学活性ビナフトールを2:3のモル比で混ぜるだけで自己組織化し、一種類のキラル超分子触媒に収束することを見出した。このキラル超分子触媒を用いて、α,β-不飽和カルボニル化合物への有機リン化合物の付加反応を試したところ、用いる基質に応じて、光学活性α-ヒドロキシホスホン酸エステルや光学活性β-ホスホリルエステルが完全な位置選択性かつ最高>99%eeのエナンチオ選択性で合成できることがわかった。本触媒反応はグラムスケールでも再現性よく進行し、簡便な実験操作で実施できるため、極めて実用性の高い合成技術である。単純な形状の低分子触媒が、一種類の超分子錯体に自己組織化して高次機能を発揮する「黄金のモル比」を見出したことは、学術的にも、特に不斉触媒反応開発において、大きなインパクトを与えた。光学活性β-ホスホリルエステルは様々な光学活性P,N-配位子へと合成変換できるため、新たな不斉触媒の開発に繋がる。また、光学活性α-ヒドロキシホスホン酸エステルは、加水分解酵素であるプロテアーゼやエステラーゼの阻害剤合成の鍵中間体となることが知られているため、抗アルツハイマー特効薬開発へ繋がることが期待される。
■研究内容が中日新聞、朝日新聞、日刊工業新聞、化学工業日報で報道された(2013.3.7)。
■VIPに選出。
■論文表紙に採用。http://onlinelibrary.wiley.com/doi/10.1002/anie.201302124/abstract
■Synfactsに論文がハイライトされた。Synfacts 2013, 9(7), 753.
▼安価な硝酸ランタン-ホスホニウム塩複合触媒を高活性中性触媒として用いるエステル交換反応
■In Situ Generated "Lanthanum(III) Nitrate Alkoxide" as a Highly Active and Nearly Neutral Transesterification Catalyst
Manabu Hatano, Sho Kamiya, Kazuaki Ishihara
Chem. Commun. 2012, 48, 9465-9467.
DOI: 10.1039/C2CC34987F

■工業化を指向した触媒的エステル交換反応の開発
波多野 学、石原 一彰
科学と工業 2012, 86(1), 3-10.
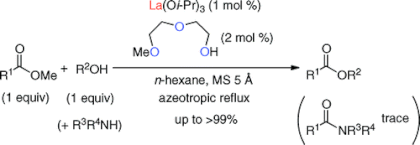
■我々は既に、低毒性なランタンイソプロポキシド触媒を用いるエステル交換反応を開発している。しかし、同触媒は高価で大量入手が困難なうえ、湿気に不安定である。そこで今回、安価で安定な硝酸ランタンとホスホニウム塩から系中で調製される触媒を創製した。その結果、等モル量のエステルと第1~3級アルコールを用いる着色を伴わない高効率エステル交換反応に成功した。従来のエステル合成触媒は、強い酸性を有するか(エステルの活性化)、強い塩基性を有するか(アルコールの活性化)のいずれかである。それに対して、申請者が開発したオニウム塩-硝酸ランタン複合触媒は全く新しい「中性」触媒である。この特徴を最大限活かして、光学活性エステルを原料とするエピ化(ラセミ化)しないエステル交換反応を達成した。80~100℃という高温条件でありながら、>99%eeを保持して、目的のエステル交換体を得ることに成功した。比較実験を行った結果、従来の複数の触媒でエピ化が観測されたことから、本触媒の優位性は明らかである。一方、炭酸ジメチルを溶媒とするエステル交換反応では、本触媒存在下、第1~3級アルコールを加えることで対応する炭酸エステルを高収率に得た。炭酸ジメチル溶媒の反応では、ホスホニウム塩の代わりにホスフィンを用いることができ、系中でホスホニウム塩の生成を伴って、硝酸ランタン-ホスホニウム塩複合触媒が調製されることで反応が円滑に進行した。さらに、ランタンイソプロポキシド触媒では困難だったグラム・スケールアップも容易に実現できた。

■日刊工業新聞(2012年8月28日(火)21面)に記事掲載
見出し「名大、ランタン触媒でエステル合成-医薬品製造の効率化へ」
http://www.nikkan.co.jp/news/nkx0720120828eaac.html
▼キラルアンモニウムビナフチルジスルホナートを触媒とするエナンチオ選択的アミナール合成
■Enantioselective Direct Aminalization with Primary Carboxamides Catalyzed by Chiral Ammonium 1,1’-Binaphthyl-2,2’-disulfonates
Manabu Hatano, Takuya Ozaki, Yoshihiro Sugiura, Kazuaki Ishihara
Chem. Commun. 2012, 48(41), 4986-4988.
DOI: 10.1039/C2CC31530K
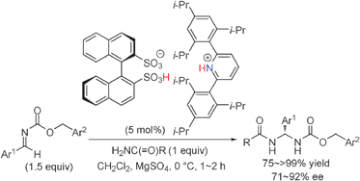
■我々はキラルビナフチルジスルホン酸(BINSA)とアキラルなアミンから系中で生じるキラルアンモニウムビナフチルジスルホナートを触媒とする不斉触媒反応を開発している。今回、予め適切に精密設計した嵩高いアキラルなアミンとBINSAの塩触媒を用いて、様々なアミド系化合物の芳香族アルジミンへのエナンチオ選択的付加反応による高効率アミナール合成法を開発した。(R)-BINSA(5 mol%)と種々のアキラルなアミン(3-10 mol%)から系中で調製したキラルアンモニウムビナフチルジスルホナート存在下、N-Cbz保護した芳香族アルジミンと芳香族アミドのエナンチオ選択的アミナール合成反応を行なった。検討の結果、BINSAと2,6位に嵩高い置換基を有するピリジンから系中で調製したキラルピリジニウムビナフチルジスルホナート(5 mol%)が高い触媒活性を示し、0°Cで1時間以内に反応が完結した。こうして対応するアミナール生成物が高収率、高エナンチオ選択的に得られた。カルバミン酸エステルも求核剤として有効であり、直截的なキラル擬ペプチド合成の優れた手法といえる。

▼立体配座柔軟性キラル超分子触媒を用いる異常な高エンドまたは高エキソ選択的不斉Diels-Alder反応
■Enantioselective Diels–Alder Reactions with Anomalous endo/exo Selectivities Using Conformationally Flexible Chiral Supramolecular Catalysts
Manabu Hatano, Tomokazu Mizuno, Atsuto Izumiseki, Ryota Usami, Takafumi Asai, Matsujiro Akakura, Kazuaki Ishihara
Angew. Chem., Int. Ed. 2011, 50(51), 12189–12192.
DOI: 10.1002/anie.201106497
■Conformationally Flexible Chiral Supramolecular Catalysts for Enantioselective Diels-Alder Reactions with Anomalous Endo/Exo Selectivities
Manabu Hatano, Kazuaki Ishihara
Chem. Commun. 2012, 48(36), 4273-4283. (Feature Article)
DOI: 10.1039/C2CC00046F
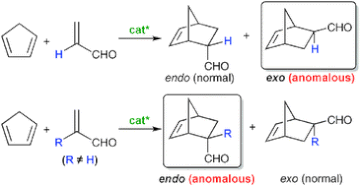
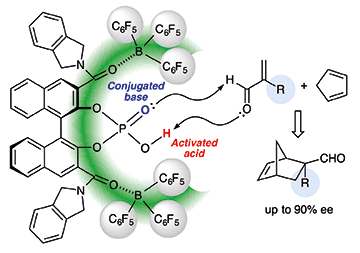
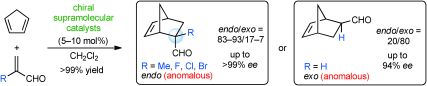
■Diels-Alder反応は、基質の組み合わせに依存して生成物のエンド/エキソ選択性が定まる。従って、ジエノフィルのみでエナンチオ面制御する従来のキラル触媒では、高エナンチオ選択性を発現できても、基質に依存したエンド/エキソ選択性を逆転させることは非常に困難である。そこで我々は、酵素のような深いキラルキャビティーによってジエノフィルだけでなくジエンも同時に制御し、単分子触媒ではできない異常なエンドまたはエキソ選択性を発現するキラル超分子触媒の開発を行っている。今回、シクロペンタジエンとα-置換アクロレインの不斉Diels-Alder反応で、通常はエキソ体が優先的に得られる反応系にも関わらず、エンド体が高収率・高エナンチオ選択的に得られるキラル超分子触媒の開発に成功した。さらに、通常はエンド体が優先的に得られるシクロペンタジエンとアクロレインでの反応系では、エキソ体が高収率・高エナンチオ選択的に得られるキラル超分子触媒の開発にも成功した。

■日経産業新聞10面に記事掲載(2011年11月11日)
「生体内の酵素に似た触媒―生成物ごとに作り分け」
■日刊工業新聞13面に記事掲載(2011年11月3日)
「特定の反応選択可能な触媒開発」
■化学工業日報1面に記事掲載(2011年10月28日)
「不斉触媒、選択性高く~設計した小分子混ぜ「テーラー・メイド化」~名大、酵素に似た機能発現」
■化学工業日報のオンライン版に記事掲載(2011年10月28日)
「名大石原教授 「テーラーメード」触媒開発」
http://www.kagakukogyonippo.com/headline/2011/10/28-4138.html
▼アリールボロン酸をアリール源とする キラル亜鉛触媒によるケトンへのエナンチオ選択的アリール付加反応
■Catalytic Enantioselective Alkyl and Aryl Addition to Aldehydes and Ketones with Organozinc Reagents Derived from Alkyl Grignard Reagents or Arylboronic Acids
Manabu Hatano, Riku Gouzu, Tomokazu Mizuno, Hitoshi Abe, Toshihide Yamada, Kazuaki Ishihara
Catal. Sci. Technol. 2011, 1(7), 1149–1158.
DOI: 10.1039/C1CY00108F
■Commercially Available Neat Organozincs as Highly Reactive Reagents for Catalytic Enantioselective Addition to Ketones and Aldehydes Under Solvent Free Conditions
Manabu Hatano, Tomokazu Mizuno, Kazuaki Ishihara
Tetrahedron 2011, 67(24), 4417–4424.
DOI: 10.1016/j.tet.2011.02.042

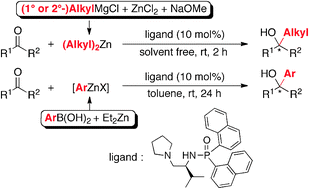
■我々はキラルホスホルアミド-亜鉛(II)触媒を用いる有機亜鉛反応剤のケトン及びアルデヒドへのエナンチオ選択的付加反応に成功している。ジアルキル亜鉛のアルキル源としてグリニャール反応剤を用いることで、幅広いアルキル基を導入することができた。一方、有機亜鉛反応剤による不斉アリール化は、アリール源としてアリールボロン酸を用いる手法が知られているが、アルデヒドよりも反応性が低いケトンに対しての報告例はわずか数例に限られている。クレマスチンの前駆体などにみられる医農薬品の重要中間体合成の観点から、ケトンへのアリール化を経る光学活性第3級アルコールの効率的合成は工業的に重要な課題である。そこで我々は、アリールボロン酸をアリール源とする有機亜鉛反応剤のケトンへのエナンチオ選択的アリール付加反応を検討した。アリール亜鉛反応剤の調製は、アリールボロン酸をMS 4Å存在下トルエン中で共沸脱水してトリアリールボロキシンへ変換し、次いでジエチル亜鉛を加えて60℃でトランスメタル化することにより、ワンポットで行なった。この溶液にキラルホスホルアミド(10 mol%)とケトンを加え、室温下24時間撹拌した。その結果、アリール付加による目的の光学活性第3級アルコールが高収率、高エナンチオ選択的に得られた。また、へテロアリール基の付加も可能だった。空気中で取り扱いが容易なうえ、低毒性かつ安価で種類豊富なアリールボロン酸をアリール源として、温和な条件下で実施できる本手法は、プロセス化学を指向した光学活性第3級アルコール合成法として重要である。

■アクセスランキングにて1位になりました
■Catal. Sci. Technol.誌の2011, vol 1, issue 7の表紙になりました

▼エナンチオ選択的アザ・フリーデル・クラフツ反応に有効なキラルビナフチルジスルホン酸アンモニウム塩触媒の設計
■Enantioselective Friedel-Crafts Aminoalkylation Catalyzed by Chiral Ammonium 1,1’-Binaphthyl-2,2’-disulfonates
Manabu Hatano, Yoshihiro Sugiura, Matsujiro Akakura, Kazuaki Ishihara
Synlett 2011, (9) 1247–1250. (Cluster, special issue)
DOI: 10.1055/s-0030-1260538

■我々は既に、モル比1:2のキラルビナフチルジスルホン酸(BINSA)とアキラルな嵩高いピリジンから系中で調製したキラルBINSAピリジニウム塩触媒を用いて、直截的不斉マンニッヒ型反応を報告している。今回、モル比1:1のBINSAとアキラルな第3級脂肪族アミンから系中で調製したキラルBINSAアンモニウム塩触媒を用いて、エナンチオ選択的アザ・フリーデル・クラフツ反応を開発した。(R)-BINSA(5 mol%)と種々のアキラルなアミン(2.5-10 mol%)から系中で調製したキラルBINSAアンモニウム塩触媒存在下、N-Cbz-アルジミン(1.5当量)とN-ベンジルピロール(1当量)を用いたエナンチオ選択的アザ・フリーデル・クラフツ反応を行なった。検討の結果、BINSA(5 mol%)とN,N-ジメチルブチルアミン(5 mol%)から調製したキラルBINSAアンモニウム塩が高い触媒活性を示した。種々のN-Cbz-アルジミンに対して、ジクロロメタン中、-78°Cで円滑に進行し、30分以内で対応する生成物が高収率・高エナンチオ選択的に得られた。得られた生成物は一回の再結晶処理で、容易に光学純度を向上させることができた。NMR解析やESI-MS測定による触媒構造の検証をふまえ、理論計算化学に基づく遷移状態の考察も行った。

▼ランタンイソプロポキシド(III)-ジエチレングリコールモノメチルエーテル触媒による高効率エステル交換反応
■Ligand-Assisted Rate Acceleration in Lanthanum(III) Isopropoxide Catalyzed Transesterification of Carboxylic Esters
Manabu Hatano, Yoshiro Furuya, Takumi Shimmura, Katsuhiko Moriyama, Sho Kamiya, Toshikatsu Maki, Kazuaki Ishihara
Org. Lett. 2011, 13(3), 426–429.
DOI: 10.1021/ol102753n
■Lanthanum(III) Isopropoxide Catalyzed Chemoselective Transesterification of Dimethyl Carbonate and Methyl Carbamates
Manabu Hatano, Sho Kamiya, Katsuhiko Moriyama, and Kazuaki Ishihara
Org. Lett. 2011, 13(3), 430–433.
DOI: 10.1021/ol102754y
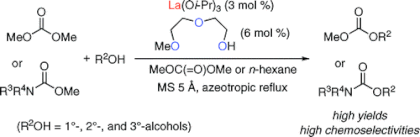
■エステル交換反応はエステルの効率的合成法の一つとして、幅広く用いられている。今回我々は、ランタンイソプロポキシドとジエチレングリコールモノメチルエーテルから系中で調製した触媒が、等モル量のアルコールとエステルによるエステル交換反応に有効であることを見出した。第2級及び第3級アルコールを用いる触媒的なエステル交換反応は、立体的要因により一般的に開発が困難であることが知られている。今回開発した触媒は、こうした反応性の低い第2級及び第3級アルコールにも問題なく適用できる点が優れている。さらに、本触媒システムをカルボン酸エステルよりも反応性の低い炭酸ジメチル及びメチルカルバメートを用いるエステル交換反応へと展開した。炭酸ジメチル溶媒中またはメチルカルバメート(等モル量/ヘキサン溶媒中)に対して、第2級及び第3 級アルコールを用いて検討を行ったところ、対応する炭酸エステル及びカルバメートを高収率、高化学選択的に得ることに成功した。これらの反応を活用し、水酸基の保護脱保護の観点からも興味深い知見が得られた。立体的要因により一般的な保護基導入が困難な第3級アルコールの有用な保護法として注目される。